塩酸セベラマー投与により血清HCO 3 濃度が低下することが報告されている 一方, 沈降炭酸カルシウム (炭酸Ca) はアルカリを供給し, 血清HCO 3 濃度を上昇させる炭酸カルシウムは塩酸や酢酸などの酸には溶けますが、塩基で溶かすことはできないのでしょうか? よろしくお願いします。 (Re) Re炭酸カルシウムについて masato 06年11月25日(土) 01時04分 >こんにちは、高校2年です。 > >炭酸カルシウムは塩酸や酢酸などの酸には溶けますが、塩基で炭酸カルシウムに塩酸を加えると、二酸化炭素ができた。 ⇧これの化学式は CaCo3 2HCL → CaCl2 H2O CO2 となるらしいのですが、 水と 塩化カルシウム は どうやって考えるのでしょうか? 炭酸カルシウムと塩酸から二酸化炭素を引くと、 Ca O H Cl が残りますが、 そっからどう組み合わせを考
化学反応式について質問です 炭酸カルシウムcaci3に塩酸hc Yahoo 知恵袋
塩酸 炭酸 カルシウム
塩酸 炭酸 カルシウム- · ベストアンサー:反応に十分な物質量の塩酸を使用しているからではないでしょうか。 CaCO3+2HCl→CaCl2+CO2+H2O 炭酸カルシウムと塩酸は12の物質量で反応します。炭酸カルシウム タンサンカルシウム calcium carbonate CaCO 3 ().天然には方解石,石灰石,大理石,あられ石,白亜として産出し,工業的にはこれらを粉砕して利用する.化学的製法で得られるものは沈降炭酸カルシウムとよばれ,カルシウムの可溶性塩の水溶液にアルカリの炭酸塩を加える




17年 平成29年度 センター試験 化学基礎 第2問 問7 くわしい解説 Youtube
· 炭酸カルシウムは、石灰岩、大理石を作る主な物質で、基本的に色は白。 ところが、次の現象を説明することになると、子供たちは混乱してきます。 石灰水に、息を吹き込むと、白くなる。 中学受験では、この現象はおなじみですが、物質名で書くと、 水酸化カルシウム水溶液+炭酸水(または二酸化炭素)=炭酸カルシウム+水+その他 となります④塩酸に水酸化ナトリウムを入れたら食塩と水になっちゃう中和反応 ③石灰水に息を吹き込むとどうなる・・・?そしてさらに吹き込んだら・・・? 水に溶けない「炭酸カルシウム 」と、水に溶ける「水酸化カルシウム」は名前が似ているものの 全くちがう物質 です。 石灰水に二酸化塩酸の物質量炭酸カルシウムの物質量発生する二酸化炭素は 211になると思うのですが,なりませんでした. 二酸化炭素の比が小さくなります.なぜですか?ヘンリーの法則と言うのが関係したりするのですか? 長くなってしまったのですが,スッキリさせたいのでよろしくお願いします
本品は希酢酸、希塩酸又は希硝酸に泡だって溶ける。 確認試験 (1)本品05g を希塩酸10mL に溶かし、煮沸し、冷後、アンモニア試液を加えて 中性とした液はカルシウム塩の定性反応を呈する。 (2)本品は炭酸塩の定性反応(1)を呈する。 純度試験回答 炭酸カルシウムは水に溶けると,カルシウムイオンと炭酸イオンに電離します.炭酸イオンは弱酸ですので,加水分解して水酸化物イオンを生じます. caco 3 → ca 2 co 3 2 co 3 2 h 2 o = hco 3 oh hco 3= co 2 ohこれらの水酸化物イオンが川の酸性を中和します. h · 2塩酸+炭酸カルシウム =塩化カルシウム+水+二酸化炭素 *弱酸(または弱塩基)の塩ここでは炭酸カルシウムに、 強酸(または強塩基)ここでは塩酸を作用させると、弱酸 (または弱塩基)ここでは二酸化炭素が発生します。 これを弱酸(または弱塩基)の遊離といい
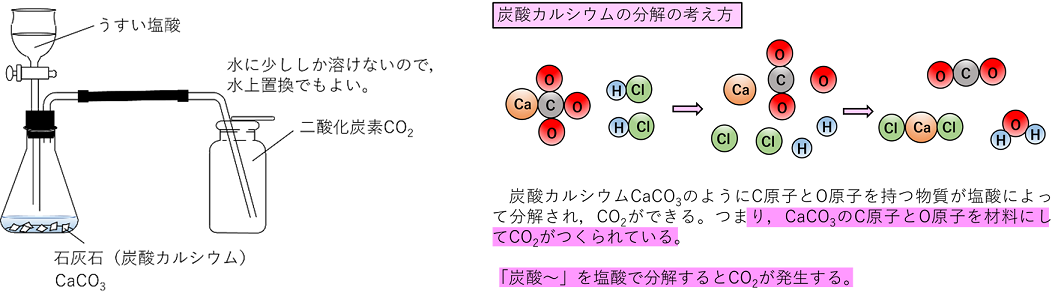
方解石 塩酸 塩化カルシウム溶液 水 二酸化炭素 (泡) ・激しく二酸化炭素の泡を出しながら溶けていく。 ・塩酸は塩化カルシウム溶液(Ca 2+ ,Cl - )となり,カルシウムの炎色反応(橙色)を示す。 ※ほかに炭酸カルシウムからなる鉱物にはあられ石もあり,これも方解石と同じ反応を示す。 苦灰石(ドロマイ ト2107 · 炭酸カルシウムに塩酸を加えて二酸化炭素を発生させた、という化学反応式を書くときに、 発生した他の物質 高校 · 炭酸カルシウム 塩酸 塩酸と炭酸カルシウムを混合したときに生成 これは2錠飲んだほうがいいのでしょうか? 翌朝にもまだ効き目が持続していて、そのまま朝一の一発も有りです。 炭酸カルシウムの塩酸への溶解 02~03年度 持続時間はバイアグラは



高校化学




Caclg Descubre Como Resolverlo En Qanda
方法は同じであるが,炭酸カルシウムと塩酸の反応は CaCO3+ 2HCl → CaCl2+ H2O + CO2炭酸カルシウムが酸に溶けることは良く知られている。しかし、約50年前に大 気と海中の二酸化炭素濃度を測定することが提案された6)が、当時その重要性に気 付いている科学者はほとんどいなかった。それは、当時の常識として、空気中に排 出される二酸化炭素は、植物や海が吸収するので73 塩酸溶状 3 74 乾燥減量 (105 ℃) 3 炭酸カルシウム(試薬) Calcium carbonate (Reagent) CaCO3 FW 序文 この規格は,1987年に第1版として発行されたISO ,Reagents for chemical analysis−Part 3 Specifications−Second seriesを基に作成した日本工業規格であるが,対応国際規格の規定の一部に市場の実 態を
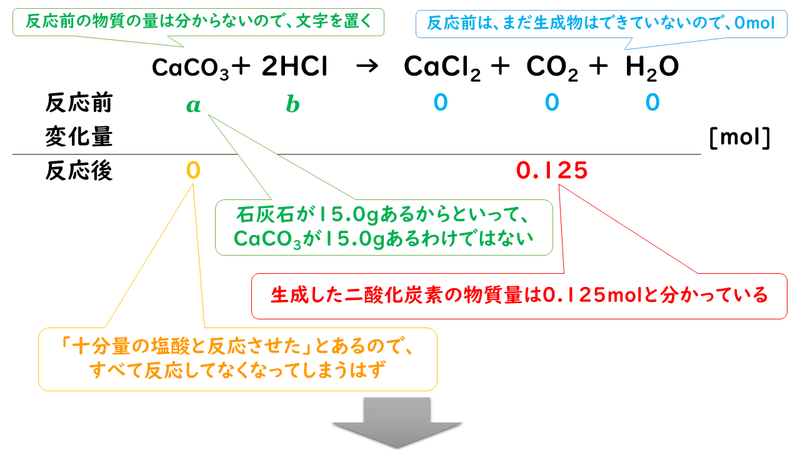



5 3 化学反応の量的関係 2 おのれー Note




この問題のグラフを見ると 加えた塩酸の体積が40mlより多くなると 発 化学 教えて Goo
炭酸カルシウムと塩酸を混ぜ合わせるとき、 その化学反応式(CaCO32HCl→CaCl2CO2H2O)と炭酸カルシウムの化学式(CaCO3)から判断して、 塩酸が充分にある場合には炭酸カルシウムの何%の質量が失われるのでしょうか? 現在高校1年で、「化学変化と物質量」についての実験からの考察炭酸カルシウム(たんさんカルシウム、caco3)は、カルシウムの炭酸塩である化合物。実験では、二酸化炭素を水酸化カルシウムと反応させてできる。 ca(oh) 2 co 2> caco 3 h 2 o 錠剤の基材、ベビーパウダー(あせ知らず)、チョーク、窯業、製紙などに用い · 炭酸カルシウムは白色の粉末で水への溶解度がとても低いです。チョークなども炭酸カルシウムからできています。 岩石中にはアラゴナイト、方解石などとして見られます。大理石も炭酸カルシウムからできています。 分子量 ;




Descubre Como Resolverlo En Qanda



硝 酸 カ ル シ ウ ム に つ い て
· 塩酸 (HCl)に炭酸カルシウム (CaCO_3)を加えると、炭酸カルシウムは塩化カルシウム (CaCl_2)というものに変わり、同時に二酸化炭素 (CO_2)が発生します。 2HCl CaCO_3 = CaCl_2 · 実験1塩酸のモル濃度の決定 炭酸カルシウムは,塩酸と反応して二酸化炭素を発生す る。この化学反応式は以下のように示される。 CaCO 3+2HCl→CaCl 2+H 2O+CO 2 濃度不明の塩酸に炭酸カルシウム粉末を加えて十分反応は,炭酸カルシウム汚泥と生物処理後の凝集沈殿汚 泥を各々別系統の脱水機で処理している。 本稿では,その施設の概要を紹介する。 1最終処分場の概要 いわき市においては,収集された一般廃棄物は, 市の焼却施設,粗大ごみ処理施設にて処理を行い, 既設埋立地で埋立処分を行っていたが,残存




わからないです 教えて頂きたいです Clear




高校化学 炭酸カルシウムと塩酸で二酸化炭素の発生 Youtube
マグネシウム+塩酸→塩化マグネシウム+水素 Mg+2HCl→MgCl2+H2 窒素 亜硝酸ナトリウム+塩化アンモニウム →塩化ナトリウム+窒素+水 NaNO2+NH4Cl →NaCl+N2+2H2O 二酸化炭素 石灰石(炭酸カルシウム)+塩酸炭酸カルシウム 石灰石を粉砕・分級することにより、さまざまな用途にご採用頂いている汎用的な原料です。 寒水石、粒状炭カル、表面処理品、高白色度品、食品添加物等特殊グレードもあります。 産地:岡山、山口、福島、岐阜、福岡。 エスカロン 品質特性一覧 ソフトン・bf製品 成分炭酸カルシウム Calcium Carbonate 沈降炭酸カルシウム CaCO 3 本品は定量するとき,換算した乾燥物に対し,炭酸カルシウム(CaCO 3)985~1005 % を含む. 確認試験 (1) 純度試験(2)の試料溶液10 mL にアンモニア試液を加えて中性とした液はカルシ



第53章 実験 2族元素の化合物
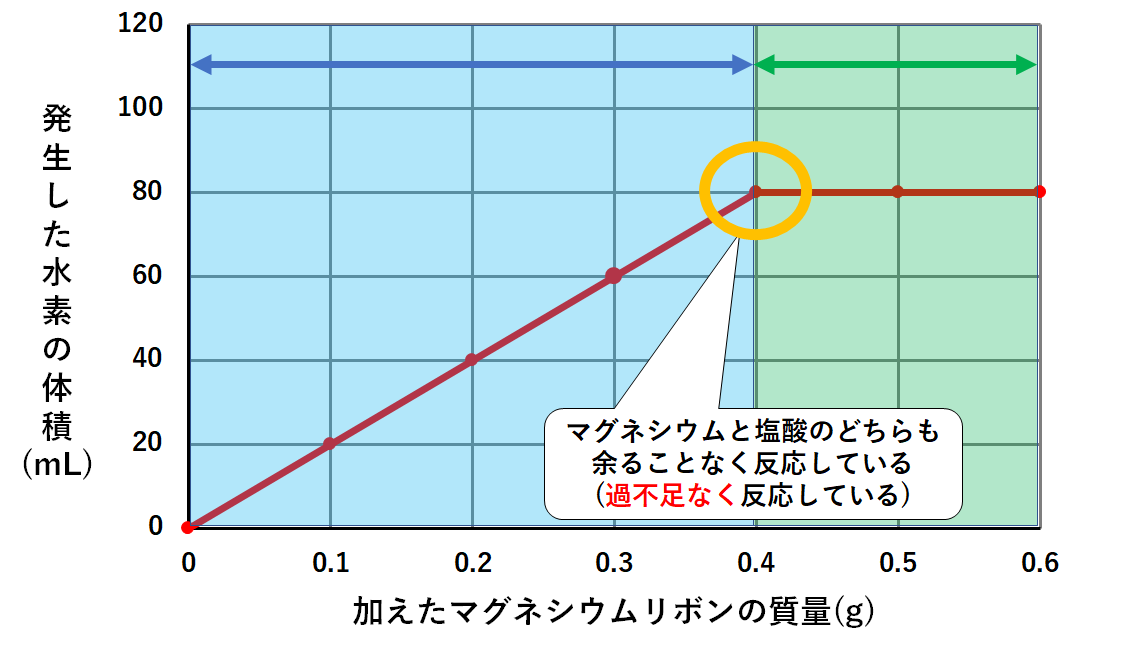



中2化学 気体の発生に関する計算 中学理科 ポイントまとめと整理
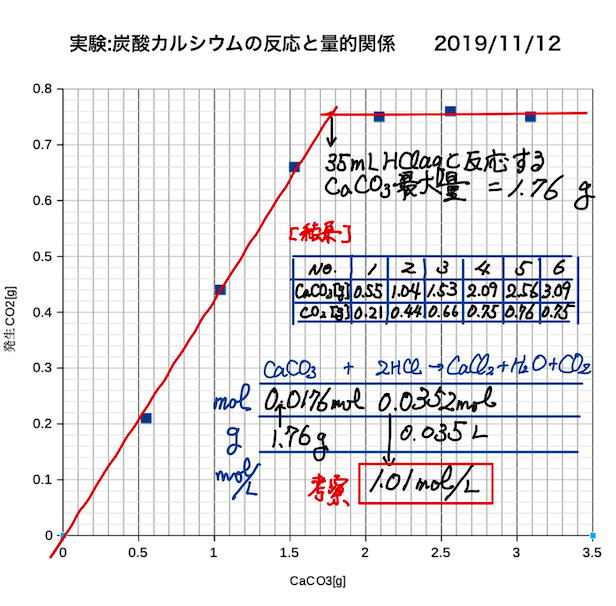
1713 · 今回は、炭酸カルシウムに塩酸を加えて二酸化炭素を発生させる実験について、その量的関係を学びました。 (1) メスシリンダーで mol/Lの塩酸を35 mLとり、0mlの三角フラスコに入れる。 (2) 炭酸カルシウムの粉末を10 gずつ6枚の薬包紙に取る。操作は炭酸カルシウムの溶解実験の場合とほぼ同様で、塩酸には標定済みの市販の 100 mol/L 分析用試薬(ファクター値 1005)を用いています。 炭酸カルシウムの溶解実験から変更したのは、共栓付きの三角フラスコを用い、また反応初期の変化をより詳細に見てもらうため最初は 02 g 加える炭酸カルシウムと塩酸の反応は, CaCO 3 + 2HCl → CaCl 2 + H 2 O + CO 2 石灰水と二酸化炭素の反応は, Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O




石灰石に塩酸を加えると何が発生する 5分で元研究員がわかりやすく解説 ページ 2 2 Study Z ドラゴン桜と学ぶwebマガジン



化学反応式について質問です 炭酸カルシウムcaci3に塩酸hc Yahoo 知恵袋
融点 5℃ 密度 2711 (カルサイ9 ) 本品を粉末とし,「沈降炭酸カルシウム」05 gに対応する量をとり,希塩酸10 mLを加えてよく振り混ぜた後, 10 ろ過する.ろ液を煮沸し,冷後,アンモニア試液を加えて中性とした液はカルシウム塩の定性反応〈 109 〉の(1), 11 (2)及び(3)を呈する. 12 2) 本品を粉末としたものは炭酸カルシウム(CaCO3) (石灰石,大理石,石灰石の変成岩) 性質 ・比重 霰(あられ)石 293 ・白色粉末。 ・うすい塩酸 と



炭酸カルシウム You Iggy




炭酸カルシウム Caco3 の化学式 組成式 構造式 電子式 分子量は
酸、希塩酸又は希硝酸に泡立って溶ける。 包 装 500g 沈降炭酸カルシウムとして、通常成人1日1~3gを3~4回に分割経 口投与する。なお、年齢、症状により適宜増減する。 使用上の注意 1慎重投与(次の患者には慎重に投与すること) (1) 腎障害のある患者症状を悪化させるおそれ炭酸カルシウムの粉末を塩酸に加えると CaCO 3 2 HCl → CaCl 2 CO 2 H 2 O という反応式にしたがって、二酸化炭素を発生して炭酸カルシウムは溶解します。《試薬》 2 mol/L の塩酸,炭酸カルシウムの粉末(石灰石) 注意 ・ 酸の取り扱いには注意を払うこと。さわってしまった場合には,すぐに手を洗うこと! ・ 炭酸カルシウムの粉末は,少量ずつ加える。反応(泡が出て激しく反応する)がおさまってから少量




実験6質量保存の法則実験導入 ラスカルのブログ
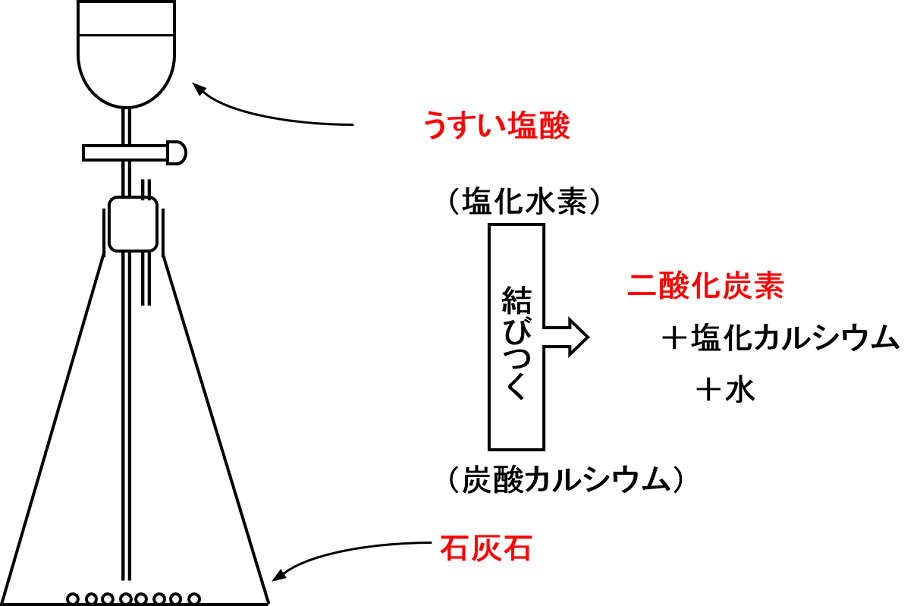



石灰石が塩酸に溶けると気体が発生 化学反応式より物質の名前に注意 中学受験ナビ
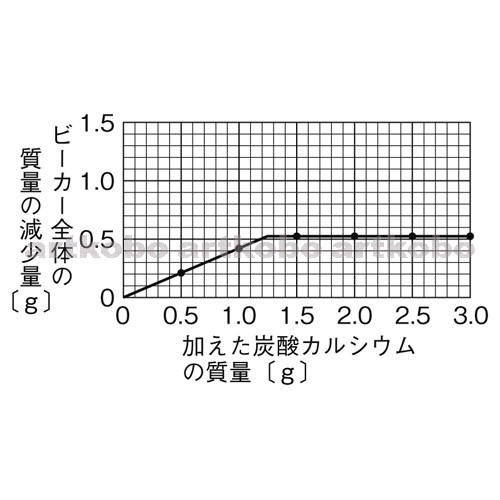
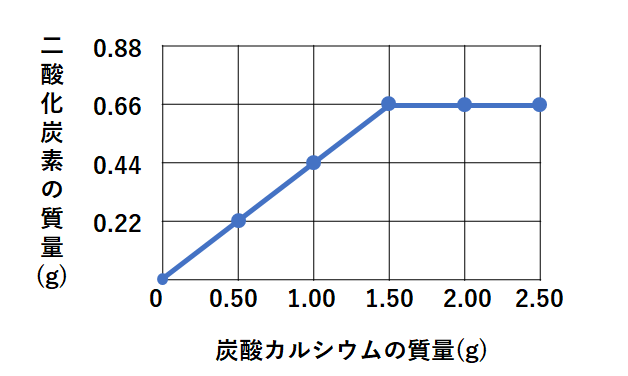
· 炭酸カルシウムと塩酸の反応について 高校の化学Iの授業で、炭酸カルシウム0g,400g,600gを量りとり、それぞれ0045molの塩化水素が含まれている塩酸30mlと反応させる実験をおこないました。 今、そのレポートを書いており「予想される二酸化炭素の発生量炭酸カルシウム(caco 3 )である方解石(石灰岩)や硫酸カルシウム(caso 4 ・2h 2 o)である石膏として多産する。また,変成岩や火成岩を構成している斜長石・角閃石類などの中に多少なりとも含まれている。地殻の構成元素としては酸素・ケイ素・アルミニウム・鉄に次いで多い(42炭酸カルシウムと塩酸の反応によってできるものは塩化カルシウムCaCl 2 と二酸化炭素CO 2 と水H 2 Oです。ビーカーの中で反応させますから,生成した二酸化炭素は空気中に逃げますね。できた二酸化炭素がすべて空気中に逃げたと仮定すると,質量の減少分は生成した二酸化炭素の質量に等しくなります。したがって,生成した二酸化炭素の物質量を求めることが




4 100 Lihat Cara Penyelesaian Di Qanda



中学3年化学実験 化学反応と量的関係 炭酸カルシウムと塩酸の反応 海城中学高等学校
· 炭酸カルシウム 性質 無色結晶または白色粉末であり、中性の水にほとんど溶けないが、塩酸などの強酸と反応して、二酸化炭素を放出する。 CaCO 3 2 HCl CaCl 2 H 2 O CO



二酸化炭素の発生 中学受験のアルファ理科実験教室




理科 水よう液 中学受験 ベネッセ教育情報サイト
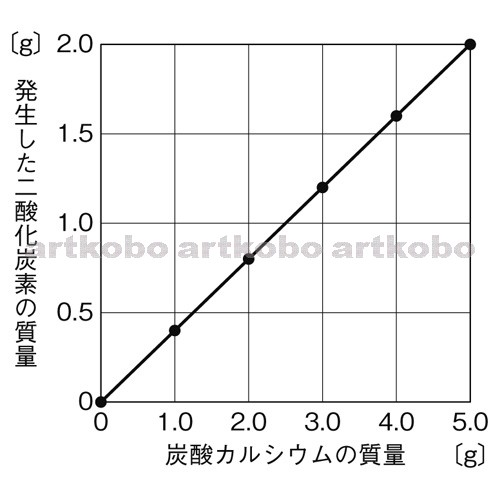



Web教材イラスト図版工房 理 14 徳島 問 04 02



炭酸カルシウム グラフ に関するq A Yahoo 知恵袋



図1 最初の画面 一部 二酸化炭素と石灰水用のapadj008 Htmlファイルから呼び出したjava Appletの実行画面を示す 上半分は塩酸 と石灰石の量から二酸化炭素の発生量を計算するプログラムであり 下半分は石灰水と二酸化炭素の量から炭酸カルシウム



シュワシュワ っと Chemchem通信




高校化学 二酸化炭素の製法と性質 映像授業のtry It トライイット



セスキ炭酸ナトリウムの塩酸への溶解 2004年度



すぐるゼミ 実戦問題



5 3 化学反応の量的関係 2 おのれー Note




の式と答えをお願いします できるだけ詳しく説明してくださると助 化学 教えて Goo




17年 平成29年度 センター試験 化学基礎 第2問 問7 くわしい解説 Youtube



水溶液に関する問題 中学受験 田中貴 Com



高校化学



気体の物質




化学 反応速度 Youtube



第17章 実験 化学反応の量的関係



炭酸カルシウムの塩酸への溶解 2002 2003年度



塩酸による反応




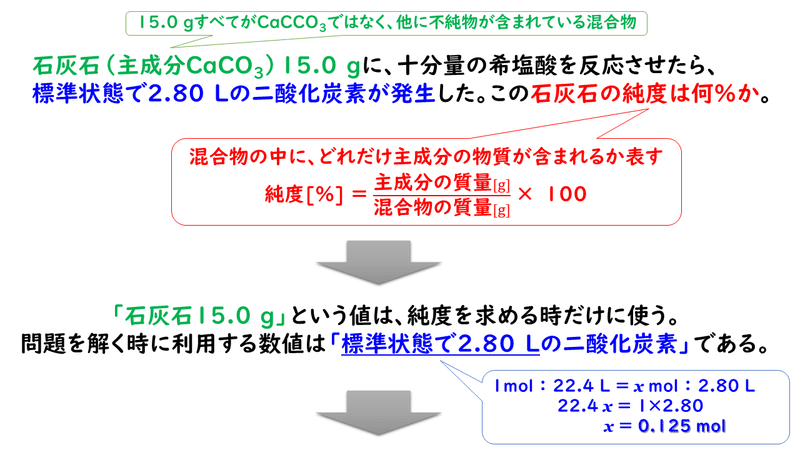
炭酸カルシウムを主成分とする石灰石に ある濃度の塩酸を加えたところ 二酸化炭素が発 Clear



実戦問題2年 その他の化学変化




炭酸カルシウムを主成分とする石灰石に ある濃度の Okwave



炭酸カルシウムの塩酸への溶解 2002 2003年度




希塩酸で洗面器の炭酸カルシウム 水垢 を除去 R271 635




3分で理解できる 二酸化炭素の性質 集め方 中学理科のすゝめ 定期考査対策から受験まで



気体に関する化学変化




1 教えてください 答えは10mlです Clear



塩



高校化学の問題です濃度が不明の塩酸25mlと炭酸カルシウムが反応して二酸 Yahoo 知恵袋



炭酸 カルシウム 組成 式




10 号 粉体状炭酸カルシウムの焼成方法 Astamuse



Web教材イラスト図版工房 理 18 滋賀 問 02 04




化学 炭酸ナトリウムと塩酸の反応 過不足なく反応 Youtube



栄光サイエンスラボ 科学実験教室 幼児 小学生 中学生 対象




5 3 化学反応の量的関係 2 おのれー Note




塩酸と大理石 章詳細 Monogatary Com




カルシウムの流れ Diagram Quizlet



無機化学 無機化学反応



中学3年化学実験 化学反応と量的関係 炭酸カルシウムと塩酸の反応 海城中学高等学校



化学です 炭酸カルシウムと塩酸の化学反応式はつくれるようになっておか Yahoo 知恵袋




炭酸カルシウムと塩酸を反応させた時に起こる化学反応式ってなんですか 反応後は塩化カル Clear




5 3 化学反応の量的関係 2 おのれー Note




L6 C8co3 2hci C8cl2h2o Co Lihat Cara Penyelesaian Di Qanda




中学受験理科講座 気体の性質 酸素と二酸化炭素




化学反応の量的関係 Caco3とhclaqの反応 高校化学の教材 分子と結晶模型の ベンゼン屋 楽天ブログ




40 G M0114 1001n1 Descubre Como Resolverlo En Qanda




画像の問題で ウの 2 5 10 2molの二酸化炭素が発生した と Clear




画像の問題で ウの 2 5 10 2molの二酸化炭素が発生した と Clear




高校化学 炭素の単体と化合物 練習編 映像授業のtry It トライイット



気体発生に関する問題 中学受験 田中貴 Com



気体に関する化学変化




合判 第1回 理科 気体の発生を解く技 駒澤塾 中学受験の算数 理科
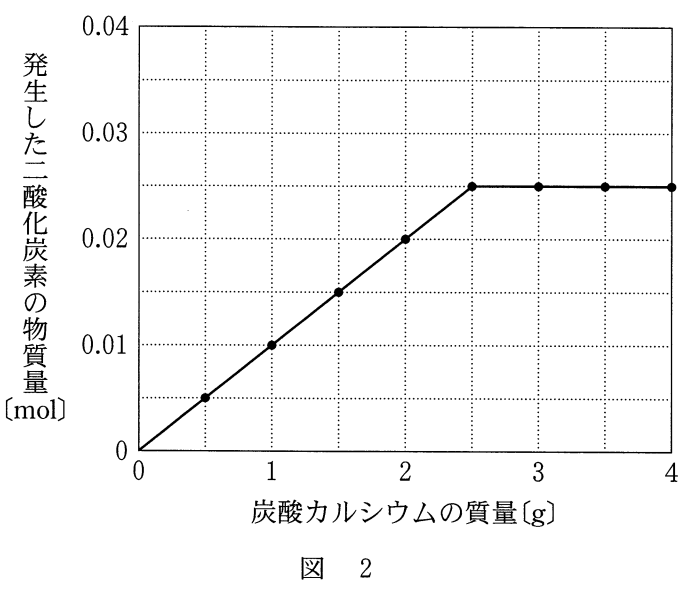



濃度が不明の塩酸25mlと炭酸カルシウムcaco が反応して二酸化炭素を発生した この反応は次の化学反応式 Caco 2hcl Cacl H O Co




3と 5 について質問です なぜ50mlだとわかるのか Clear




理科 水よう液 中学受験 ベネッセ教育情報サイト




15 号 有機分子内包結晶性炭酸カルシウム及びその製造法 Astamuse




高校化学 二酸化炭素の製法と性質 映像授業のtry It トライイット
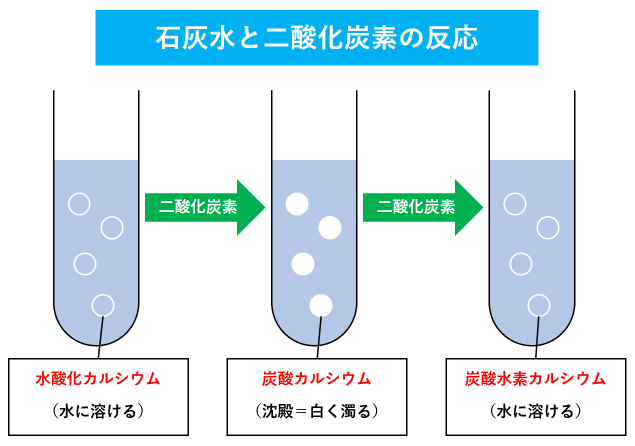



石灰水と二酸化炭素の反応を覚えよう 消石灰の水溶液が白く濁るのはなぜ 中学受験ナビ



化学で 濃度が不明な塩酸25mlと質量の異なる炭酸カルシウムを反応させる Yahoo 知恵袋



実験11 ニ酸化炭素をつくって調べよう 1年理科 化学 Takaの授業記録12




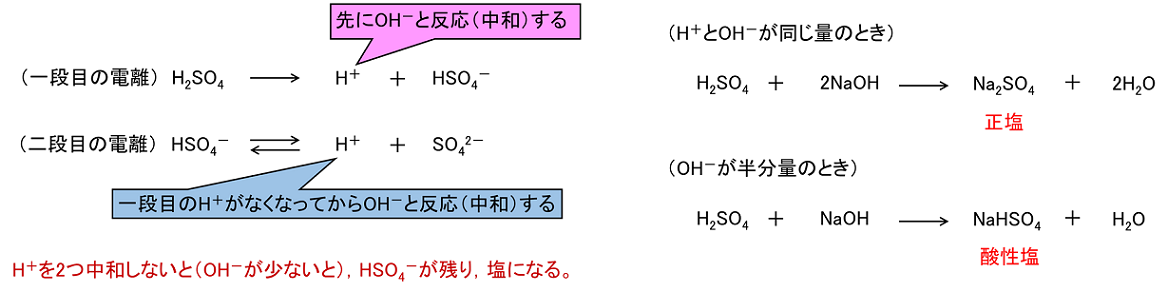
いろいろな中和反応 塾の質問箱



18年 愛媛県公立入試問題 解説 中学理科 ポイントまとめと整理




トップページ Kumonotaira



制酸剤組成物



炭酸カルシウムと塩酸が反応するとなぜ炭酸ではなく水と二酸化炭素が Yahoo 知恵袋



塩酸 と 水 酸化 カルシウム の 中 和



量的関係 問題 センター試験演習 化学基礎 高校化学net参考書



炭酸カルシウムの塩酸への溶解 2002 2003年度



第17章 実験 化学反応の量的関係



無題ドキュメント



文系2単位で化学反応の量的関係 Caco3とhclaqの反応 高校化学の教材 分子と結晶模型の ベンゼン屋 楽天ブログ



実戦問題2年 その他の化学変化




11 号 粉体状炭酸カルシウムの焼成方法 Astamuse




ピートル 血液透析患者 炭酸カルシウム併用試験 キッセイ薬品工業株式会社


0 件のコメント:
コメントを投稿